Thermodynamique et cinétique chimique
.......... .CONDITIONS DE RÉFÉRENCE,
STANDARD, NORMALES
Définir ...
La grandeur ΔH ainsi que d'autres valeurs sont données dans
différentes tables dans des conditions bien déterminées :
il s'agit des Conditions de
Référence
de Température et de Pression ou CRTP
(T = 298,15 K et P = 1 atm),
actuellement,
on utilise les Conditions Standard
de Température et de Pression
ou CSTP (T = 298,15 K et P = 1 bar) ce qui a amené
à
proposer de nouvelles valeurs des constantes (par exemple,
température d'ébullition d'un corps) puisqu'elles avaient été définies
à pression atmosphérique (la variation étant minime).
Il ne faut pas confondre ces conditions avec les Conditions
Normales
de température et de pression ou CNTP
utilisées pour
les gaz (T = 273,15 K et P = 1 atm).
Dans les calculs nous utiliserons pour la température, sauf indication contraire, les valeurs
arrondies 298 et 273 K.
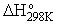 représente la variation d'enthalpie de la réaction à 298 K (c'est à dire Ti = Tf = 298 K) sous
une pression constante
représente la variation d'enthalpie de la réaction à 298 K (c'est à dire Ti = Tf = 298 K) sous
une pression constante
de 1 atmosphère (CRTP) ou 1 bar (CSTP).
Elle implique également que les produits et les réactifs soient dans les quantités
stœchiométriques
et que la réaction soit
totale même si ce n'est pas le cas (les états physiques et les variétés
allotropiques des produits et des réactifs doivent
être précisés).
L'exposant 0 indique qu'il s'agit d'une réaction où les corps sont considérés
CRTP (1 atmosphère
et 298 K) ou CSTP (1 bar
et
298 K, les corps gazeux étant considérés comme parfaits) ; dans un souci de simplification on admet que l'exposant
0 pour
ΔH
suffit pour indiquer que la réaction à lieu dans
les conditions de référence ou standard (dans les exercices nous
considèrerons
généralement les conditions de référence).
Remarques :
● ΔH0 de formation d'un élément simple pris dans son état le plus stable à 298K est
égal à 0.
Exemples : H2 (g) H2O (g) H2O (l) O2 (g)
ΔH0 en kJ.mol-1
0 - 241,8 - 285,8 0
● ΔH d'une réaction ne varie pas avec la pression, il ne dépend que de T.
A retenir
Les conditions de référence (25 °C et 1 atm), conditions standard (25 °C et 1 bar) et les
conditions normales
(0 °C
et 1 atm).
La symbolisation des conditions de référence (0).
L'enthalpie de formation dans les conditions de référence est nulle pour les corps purs
simples.
Thermodynamique et cinétique
Conditions de référence Exercices
Pr Robert Valls & Dr Richard Frèze
robert.valls@univ-amu.fr