Thermodynamique et cinétique chimique
CLAPEYRON
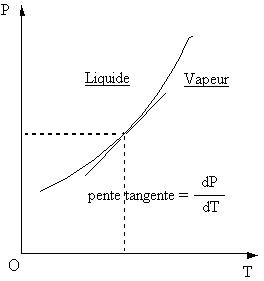
Définir ... FORMULE DE CLAPEYRON : DIAGRAMME P = f (T)
La chaleur latente de changement d'état L à la température T est la quantité de chaleur qu'il faut fournir
à l'unité de masse
du corps pur (à la température T et à la pression d'équilibre P) pour le faire changer
d'état
à la même température et à la
même pression.
La valeur de L est liée à la pente de la courbe de pression de vapeur saturante par la
formule de
Clapeyron :
|
 |
|
dP |
L |
|
|
dP |
|
—— = |
——
|
ou |
L =
T.ΔV |
—— |
|
dT |
T.ΔV |
|
|
dT |
(on peut trouver dans cette expression L ou ΔHv)
Dans la formule de Clapeyron :
P et T sont la pression et la température d'équilibre,
L ou ΔH est l'enthalpie correspondant au changement d'état
(ou chaleur latente de changement d'état),
ΔV est la variation du volume molaire associée à
ce changement d'état (chaleur de fusion, de
vaporisation ou de sublimation). |
Remarque 1 : pour la fusion, la pente de la courbe P = f(T) est très forte car ΔV est petit le liquide et le
solide
ayant
des volumes peu différents.
Tfusion varie donc peu avec la pression.
L est toujours positif pour la fusion (on doit chauffer) et
le signe de la pente est positif en général car Vliquide > Vsolide.
Remarque 2 : pour l'eau c'est l'inverse et la pente est négative.
EXPRESSIONS DE LA FORMULE DE CLAPEYRON
Plusieurs expressions de cette relation peuvent être proposées pour les différents changements d'état
et
noter que pour
la vaporisation, ΔV = Vg - Vl ≈ Vg - 0 = R . T / P (pour une mole)
|
|
dP |
L |
|
dP |
L |
d lnP |
|
|
donc
|
—— = |
—— . P |
soit |
—— = |
—— = |
——— |
|
|
|
dT |
R.T2 |
|
PdT |
R.T2 |
dT |
|
|
|
d lnP |
ΔVvap |
|
|
pour la vaporisation d'un
corps, cette formule s’écrit : |
——— = |
————
|
P
étant la pression de vapeur saturante. |
|
|
dT |
R.T2 |
|
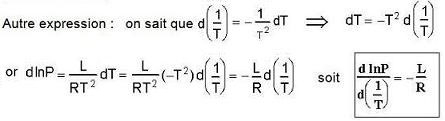
|
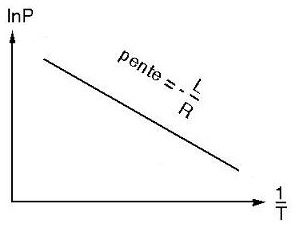
En travaux pratiques :
on peut tracer le logarithme Népérien de la pression
(lnP)
en fonction
de l'inverse de la température (1/T)
la pente est égale
à - L / R
où L est la chaleur latente de fusion ou vaporisation
et
R la constante des gaz parfaits |
 |
Thermodynamique et cinétique
Clapeyron
Exercices
Pr Robert Valls & Dr Richard Frèze
robert.valls@univ-amu.fr