 Il faut compléter avec la
troisième, ce qui demande une nouvelle
Il faut compléter avec la
troisième, ce qui demande une nouvelleécriture de la première réaction.
Enthalpie de formation : pour écrire l'équation
correspondant à l'enthalpie de formation d'un
corps composé, il suffit de
trouver les corps simples à partir desquels on peut
l'obtenir (les corps
simples n'ont pas d'enthalpie de formation puisqu'ils se
forment
à partir d'eux
même).
ΔH (formation de l'eau) est défini à partir de la réaction : 1/2 O2 + H2 → OH2 (on écrit d'abord à droite de la flèche).
Enthalpie de combustion : pour écrire
l'équation correspondant à l'enthalpie de combustion
d'un corps, il suffit de
trouver les corps composés que l'on obtient par combustion de ce corps (la difficulté se trouve dans le fait d'équilibrer la
réaction).
ΔH (combustion de l'ammoniac) est défini à partir de la réaction :
NH3 + 3/4 O2 → 1/2 N2 + 3/2 OH2 (on écrit d'abord à gauche de la flèche).
La formation de l'eau peut être vue comme la combustion du dihydrogène : H2 + 1/2 O2
→ OH2
Enthalpie de liaison : elle correspond à
l'enthalpie de formation d'une liaison entre deux
atomes initialement libres et
gazeux. L'enthalpie inverse (signe
opposé) est plus facile à comprendre
puisqu'on part d'une molécule, par exemple
diatomique,
et qu'on la chauffe
jusqu'à rompre la
liaison entre les deux atomes et obtenir deux atomes non liés
(libres) et
gazeux, qui
justifient de la
rupture de la liaison.
Dans tout ce qui va suivre, il faut noter que la température est constante
car il ne serait
pas possible de parler
d'enthalpie
de réaction sans être en isotherme (et
isobare).
On peut donc construire des cycles pour déterminer des enthalpies de réactions,
par exemple :
des enthalpies de réactions difficiles à mesurer :
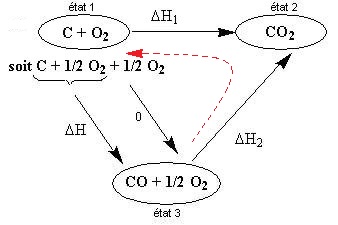
C + 1/2 O2 → CO avec ΔH à T = ?
c'est une enthalpie difficile à mesurer
C + O2 → CO2 avec ΔH1 à T = - 94
kcal
c'est une enthalpie facile à mesurer
On peut mesurer : CO + 1/2 O2 → CO2 avec ΔH2
à T = - 68,2 kcal
On construit un cycle (isotherme) qui va permettre de calculer la valeur de ΔH à
T.
On commence par la réaction qui renferme le plus d'atomes, par exemple, la
deuxième
réaction proposée.
 Il faut compléter avec la
troisième, ce qui demande une nouvelle
Il faut compléter avec la
troisième, ce qui demande une nouvelle
écriture de la première réaction.
On sait que l'enthalpie en isotherme :
composé A → composé A est
nulle
et on peut
fermer le cycle.
Pour passer de "état 1" à "état 3" (ΔH), il y a deux possibilités :
- le chemin le plus court (ΔH)
- le
chemin "état
2", "état 1" puis "état 3" (Σ ΔHi)
Soit l'égalité : ΔH = ΔH1 - ΔH2 (car ΔH2 est en
sens inverse du
parcours "état 2" vers "état 3").
On obtient : ΔH = (- 94) - (- 68,2) = - 25,8 kcal
Les deux enthalpies connues et la construction du cycle, ont permis d'obtenir l'enthalpie impossible à mesurer.
Exemples complémentaires
A retenir
Les définitions des différentes enthalpies.
Les conditions attachées à un cycle thermodynamique.