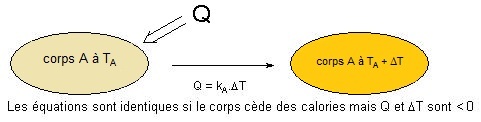
On considère un corps A à la température TA qui reçoit une quantité de chaleur Q,

avec Q = kA.ΔT pour ce schéma Q > 0 et ΔT > 0
si l'on transfère 2 Q, on écrit 2 Q = kA.Δ' T = kA . 2 ΔT ...
kA et kB ne changent pas et sont caractéristiques des corps A et B
De plus, on constate expérimentalement que ki est proportionnel à la masse du corps.
On écrit : .........ki = mi . ci .........alors .........Q = mi . ci . ΔT
ci est une constante caractéristique de chaque corps, c'est la capacité calorifique
La capacité calorifique
Par définition, la capacité calorifique est la quantité de chaleur qu'il est nécessaire de fournir
à 1 g d'un corps pour élever
sa température de 1K.
Définition : On a donc défini la calorie comme la quantité de chaleur nécessaire pour réchauffer
un gramme d’eau de
un degré (1 calorie = 4,18 Joule).
Pour plus d'informations, voir le lien "capacité
calorifique".
Cas des gaz
Pour les gaz suivant que l'échauffement est réalisé à pression constante ou à volume constant
on parle de Cp ou Cv,
il s'agit de la capacité calorifique molaire (l'unité est le J.mol-1.K-1)
à pression
constante ou à volume constant.
Pour plus d'informations, voir le lien "capacité
calorifique molaire".
A retenir
La définition de la chaleur.
La définition de la capacité calorifique.