Le comportement des liquides miscibles en toutes proportions (voir liquide-vapeur) comme dans
le cas d'un mélange
eau-éthanol a été étudié.

Mais la solubilité peut être partielle ou encore
limitée sur une zone de concentration.
En dehors de cette zone, le liquide A est saturé
en B et réciproquement, il existe une zone de
concentration où le liquide B
est saturé en A.
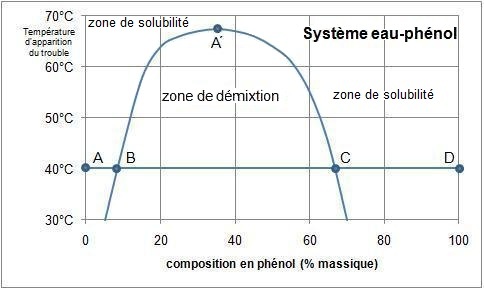
Un exemple est celui du mélange eau–phénol,
présentée ci-contre.
La méthode utilisée pour la détermination
expérimentale des diagrammes d'équilibre
liquide-liquide
est celle de
l'apparition du point
trouble.
Cette méthode consiste à abaisser la température
du mélange et à déterminer la température à
laquelle apparaît un
trouble (début de la démixtion).
A 40 °C par exemple :
- on constate que l'on peut ajouter jusqu'à 8 % massique de phénol avant l'apparition du trouble (point B)
- à partir de 66 % de phénol (point C) le mélange redevient homogène jusqu'au point D
On peut écrire que le phénol est partiellement miscible à l'eau (l’eau absorbe jusqu’à 8 % massique de phénol)
et l'eau est
partiellement miscible au phénol (le phénol absorbe jusqu’à 34 % de son poids en eau).
Au dessus de 67 °C les deux liquides sont miscibles en toutes proportions (point A').
L’augmentation de la température a pour effet d’augmenter la solubilité réciproque de chacun des
deux
constituants.
Entre ces deux limites un mélange eau-phénol se sépare en deux phases : un phase aqueuse riche
en phénol et une phase
phénolique riche en eau. On observe donc une zone de non miscibilité encore
appelée lacune de miscibilité.
On atteint éventuellement une température où la solubilité réciproque devient totale.
C’est ce que l’on appelle la température critique de la solution.
Par exemple, dans le cas du mélange eau–aniline, la température critique est de 168 °C.
Donc, à 40 °C, un mélange à 20 % de phénol se divise en deux phases :
- une riche en eau (8 % de phénol, point A)
- une riche en phénol (66 % de phénol, point B)
la proportion de chaque phase pouvant être calculée par
la
règle du levier
entre A et B.
|
D’autres systèmes binaires sont miscibles en toutes proportions à basses températures et présentent une région à deux phases au-dessus d’une certaine température.
C’est le cas du mélange eau–triéthylamine.
- une phase aqueuse pauvre en triéthylamine Au-dessous de 18,5 ºC (point A'), le mélange est homogène quelles que soient les proportions. |
Cette partie de cours est principalement constitué de
connaissances aussi vous devez la lire attentivement et la retenir.