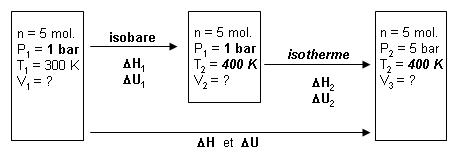

Calculons les trois volumes :
V1 = nRT1 / P1 = 5 x 8,31 x 300 / 105
= 0,12465 m3
V2 = nRT2 / P1 = 5 x 8,31 x 400 / 105
= 0,16620 m3
V3 = nRT2 / P2 = 5 x 8,31 x 400 / 5.105
= 0,03324 m3
|
400 |
|
|
Pour l'isobare : |
ΔH1 = 5 ∫ (27,17 + 0,0048 T) dT |
|
|
300 |
ΔH1 = 5 x (27,17 x 100) + 0,0048 / 2 (4002 - 3002)
= + 14316 J
ΔU1 = ΔH1 - P.(V2
- V1) = + 14316 - 101325 x (0,16620 - 0,12465) = + 10106 J
La deuxième transformation est une isotherme, on peut énoncer la loi de Joule
qui précise que
"l'énergie interne d'un gaz parfait ne dépend que de sa température".
Alors, en isotherme ΔUT = ΔHT
- PΔV = 0
soit
ΔHT
= PΔV = - WT
ΔU2 = 0
ΔH2 = 101325 x (0,03324 - 0,16620) = - 13472 J
Cliquer sur la figure pour retrouver le schéma initial

On remarque qu'il y a deux chemins pour aller de l'état initial vers l'état
final :
- celui qui passe par les
deux transformations
- celui qui est
direct
or la variation d'enthalpie et d'énergie interne ne dépendent pas du chemin
suivi.
donc ΔH = ΔH1
+ ΔH2
et
ΔU = ΔU1 + ΔU2
Soit :
ΔH = + 14316 + (- 13472) = + 844 J
ΔU = + 10106 + 0 = + 10106 J
Pensez à revenir à la page
"Savoirs
et savoir faire"
pour vérifier vos acquisitions.