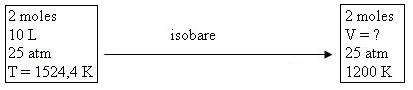
On applique la loi des gaz parfaits dans chaque cas :
T1 = P1V / nR
T2 = P2V / nR
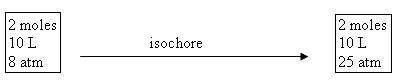
T1 = 8 x 10 / 2 x 0,082 = 487,8 K
T2 = 25 x 10 / 2 x 0,082 = 1524,4 K
|
1524,4 |
|
|
c'est une isochore donc |
ΔH1 = ∫ (11,8 + 0,0012 T) dT |
|
|
487,8 |
ΔH1 = 2.[11,8.(T - T0) + 0,0012 / 2 (T2 - T02)]
= + 26951 J
et puisqu'on est en isochore ΔH1 = ΔU1
= + 26951 J
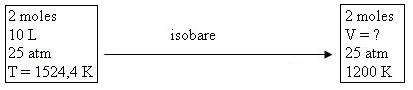
V = V0.T / T0 = 10 x 1200 / 1524,4 = 7,872 L
ΔH2 = 2 x 22,1 x (1200 - 1524,4) = - 14321 J
ΔU2 = ΔH2 - 101325 x (7,872 - 10). 10-3
= - 14105 J
Pensez à revenir à la page
"Savoirs
et savoir faire"
pour vérifier vos acquisitions.