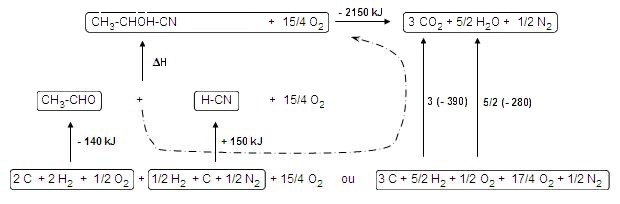
Calculer l'enthalpie de cette réaction en utilisant les données suivantes :
ΔHformation (HCN) = + 150 kJ
ΔHformation (CH3CHO) = - 140 kJ
ΔHformation (H2O liquide) = - 280 kJ
ΔHcombustion (carbone graphite) = - 390 kJ (combustion
complète)
Les réactions sont les
suivantes :
CH3-CHO + H-CN → CH3-CHOH-CN
ΔH = ?
C + 1/2 H2 + 1/2 N2 → HCN
ΔHformation (HCN) = + 150 kJ
2 C + 2 H2 + 1/2 O2 → CH3CHO
ΔHformation (CH3CHO) = - 140 kJ
H2 + 1/2 O2 → H2O liquide
ΔHformation (H2O liquide) = - 280 kJ
C + O2 → CO2
ΔHcombustion (C) = - 390 kJ
équilibrer la dernière est plus complexe :
1- on écrit réactifs et produits
CH3-CHOH-CN + O2 → CO2 + H2O + N2
2- on équilibre par type d'atome (C)
CH3-CHOH-CN + O2 → 3
CO2 + H2O + N2
3- puis (N)
CH3-CHOH-CN + O2 → 3
CO2 + H2O + 1/2 N2
4- puis (H) mais attention c'est H2O
CH3-CHOH-CN + O2 → 3
CO2 + 5/2 H2O +
1/2 N2
5- puis (O), on termine par O qui se trouve souvent dans plusieurs
réactifs et produits
CH3-CHOH-CN + ? → 3 CO2
+ 5/2 H2O + 1/2
N2
1 O
6 O 2,5 O
soit 8,5 O au total
pour équilibrer il faut 8,5 - 1 = 7,5 O = 15/2 O = 15/4 O2
en conclusion :
CH3-CHOH-CN + 15/4 O2 → 3 CO2 + 5/2 H2O
+ 1/2 N2
ΔHcombustion (CH3-CHOH-CN) = -2150 kJ
c'est la réaction qui contient le plus d'atomes.
Pour l'obtenir il faut construire un cycle faisant intervenir les enthalpies
proposées :
ΔHcombustion (CH3-CHOH-CN), puis
ΔHréaction,
puis
ΔHformation (HCN), puis ΔHformation (CH3CHO)
Cliquer sur la figure pour retrouver la présentation initiale

Il faut
réécrire les corps simples pour qu'ils
conduisent aux produits de la première
réaction et
on obtient le
cycle attendu.
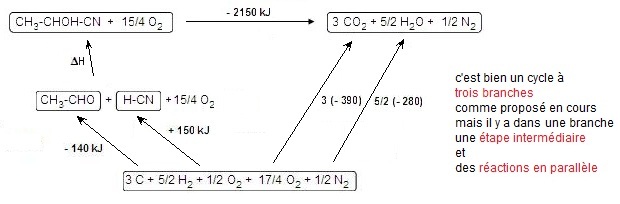
On en déduit : ΔH = -(-140) - (+ 150) + 3 x (-390) + 5/2 (- 280) - (-2150) = + 270 kJ
Pensez à revenir à la page
"Savoirs
et savoir faire"
pour vérifier vos acquisitions.