Cliquer sur la figure pour retrouver la présentation initiale.
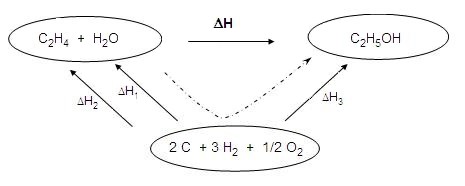
On en déduit : ΔH = - ΔH1 - ΔH2 + ΔH3 = -(-241,9) - (+ 52,3) + (- 235,6) = - 46 kJ
Pensez à revenir à la page "Savoirs et savoir faire" pour vérifier vos acquisitions.
L'enthalpie de formation a été décrite, il faut revoir la définition si nécessaire.
La réaction de formation de :
- H2O (g) s'écrit...............
H2 (g) + 1/2 O2 (g) → H2O
|
C2H4 (g) + H2O (g) → C2H5OH
(g) 2 C (s) + 3 H2 (g) + 1/2 O2 (g) → C2H5OH (g) .H2 (g) + 1/2 O2 (g) → H2O (g) 2 C (s) + 2 H2 (g) → C2H4 (g) |
ΔH = ?
les deux premières réactions ΔH3 = - 235,6 kJ sont celles qui contiennent le ΔH1 = - 241,9 kJ plus d'atomes ΔH2 = + 52,3 kJ |
On utilise les deux premières puis les deux autres.

Cliquer sur la figure pour retrouver la présentation initiale.
Pensez à revenir à la page
"Savoirs
et savoir faire"
pour vérifier vos acquisitions.