- une réaction de combustion du soufre qui s'écrit............................. S + 3/2 O2 → SO3
- une réaction de formation du trioxyde de soufre qui s'écrit.............. S + 3/2 O2 → SO3
L'enthalpie de formation du trioxyde de soufre ΔHSO3 = ΔH 1 = - 395 kJ
L'enthalpie de formation de SO2 s'écrit : S (s) + O2 (g) → SO2 (g)
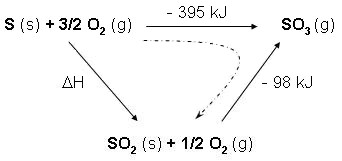
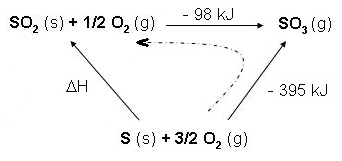
Pour l'obtenir il faut construire un cycle faisant intervenir les enthalpies proposées :
|
S (s) + 3/2 O2 (g) → SO3 (g) SO2 (g) + 1/2 O2 (g) → SO3 (g) S (s) + O2 (g) → SO2 (g) |
ΔH1 = - 395 kJ cette équation ou la
suivantes ΔH2 = - 98 kJ contiennent le plus d'atomes ΔH = ? les des cas sont présentés |


On en déduit : ΔH = (-395) - (- 98) = - 297 kJ ΔH = (-395) - (- 98) = - 297 kJ
Pensez à revenir à la page "Savoirs et savoir faire"
pour vérifier
vos acquisitions.