| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

RELATION STRUCTURE-PROPRIÉTÉS
Connaissances ... définir ... les propriétés des verres ...
Les verres sont des matériaux amorphes obtenus le plus souvent par solidification d'un mélange de composés fondu à une température
élevée, puis refroidi.
Le terme amorphe signifie que le matériau n'a pas une structure régulière avec un arrangement périodique des atomes sur une longue
distance, comme c'est la cas pour les matériaux cristallins.
Dans un verre, l'absence de cristallisation est favorisée par trois facteurs : une viscosité suffisante (100 à 1000 Pa.s), une vitesse de refroidissement importante et l'absence de germes de nucléation.
Un phénomène particulier distingue les verres d'autres solides amorphes : la transition vitreuse.
Ce phénomène est illustré sur la figure ci-dessous, qui présente l'évolution du volume en fonction de la température d'un matériau hypothétique, qui à l'état solide peut être soit sous forme de verre, soit sous forme cristalline. Pour le solide cristallin, on considère le cas le plus général où le volume augmente lors de la fusion.
La transition vitreuse
Les verres fondus présentent un comportement particulier lorsqu'on les refroidit.
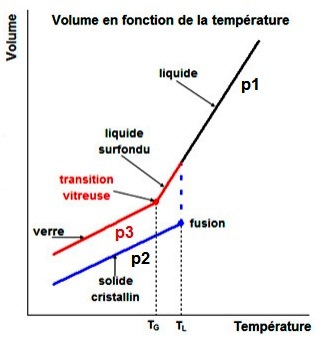 |
Considérons le refroidissement d'un solide fondu conduisant à un solide cristallin :
Au cours de la baisse de température, le volume diminue avec une
pente p1. Considérons le refroidissement d'un solide fondu conduisant à un verre amorphe :
Au cours de la baisse de température, le volume diminue avec une pente p1. |
Le terme "verre" s'applique à tout solide amorphe présentant le phénomène de transition vitreuse.
De nombreux matériaux peuvent entrer dans cette catégorie : certains alliages métalliques, liquides moléculaires, polymères ...
Ici nous ne parlerons que des verres "classiques" dont le constituant principal est la silice (SiO2).
Cette silice est associée à d'autres oxydes, qui permettent d'abaisser sa température de fusion par formation d'eutectiques, et d'obtenir
des propriétés physiques particulières.
Les principaux oxydes utilisés sont : Na2O, BaO, CaO, Al2O3, B2O3, MgO, PbO.
Dans la silice amorphe, les liaisons Si-O sont en partie covalentes et en partie ioniques, on dit qu'elles sont ionocovalentes.
Les liaisons covalentes, qui sont des liaisons fortes, étant nombreuses ( ≈ 50 %), la température de fusion de la silice est élevée car
supérieure à 1700 °C.
Un ajout modéré de métaux alcalins ou alcalino-terreux, qui ont une valence plus faible que le silicium (Si4+ valence 4 ; Na+ valence 1; Ca2+ valence 2) conduit à la formation de liaisons Métal-O à caractère ionique plus marqué, donc moins fortes, ce qui fait baisser nettement la température de fusion (une liaison ionique Na-O, est environ 5 fois plus faible qu'une liaison ionocovalente Si-O).
|
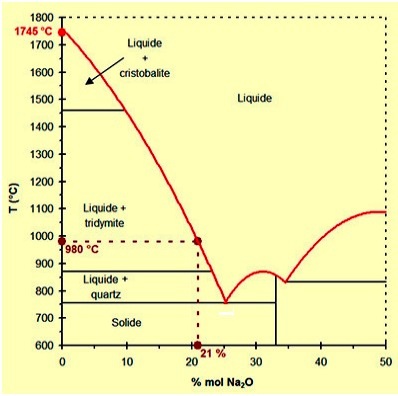
Les verres les plus courants sont les sodocalciques de composition : SiO2 + Na2O + CaO + quelques additifs.
L'oxyde de sodium permet d'abaisser la température de fusion et l'oxyde
Alors que la silice pure à une température de fusion voisine de
1745 °C, La présence du sodium va modifier le réseau de la silice du verre. |
 |
Influence de Na2O sur la formation du verre de silice (structures représentées uniquement en 2D)
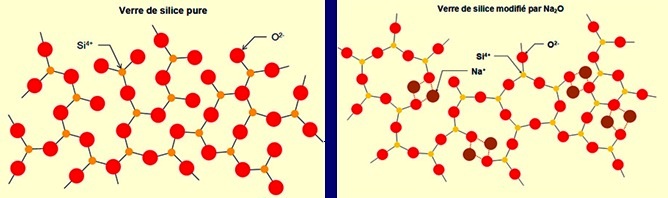
Si le rapport molaire O / Si devient un peu trop fort (> 2,5), de nouvelles liaisons apparaissent dans le réseau qui devient alors plus rigide,
et la solidification conduit à un produit cristallisé.
Pour obtenir une structure vitreuse il faut donc utiliser des conditions particulières de refroidissement (vitesse très élevée).
La propriété spécifique des verres, la plus connue est optique, c’est la transmission de la lumière puisque les verres les plus courants sont
transparents à la lumière visible (400 ≤ λ ≤ 700 nm), on se propose de détailler, par exemple, à travers le photochromisme.
| Pr Robert Valls | robert.valls@univ-amu.fr |