| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

RELATION STRUCTURE-PROPRIÉTÉS
Connaissances ... définir ... les métaux ...
Les métaux sont les éléments chimiques qui possèdent un ensemble de propriétés spécifiques :
• une bonne conductivité thermique,
• une
bonne conductivité électrique qui diminue avec la température,
• une certaine élasticité,
• un éclat métallique,
• des oxydes basiques.
Cependant il faut noter que les métaux sont assez rarement utilisés à l'état pur, mais surtout sous forme d'alliages.
Un alliage est un mélange de plusieurs métaux, ou d'un métal avec certains éléments non métalliques.
Exemples : acier au carbone (Fe + C), ferro-silicium (Fe + Si), aciers inoxydables (Fe + Ni + Cr), laiton (Cu + Zn).
Les alliages sont préférés aux métaux purs, car ils permettent d'améliorer une ou plusieurs caractéristiques souhaitées (dureté, résistance à la corrosion, perméabilité magnétique, ...) ou une meilleure combinaison de propriétés.
A l'état solide, les métaux sont formés de cristaux dont la cohésion est assurée par une liaison d'un type particulier, la
liaison métallique.
Dans un tel cristal, les électrons de valence sont délocalisés dans l'ensemble de la structure.
|
Le réseau cristallin peut être considéré comme un réseau d'atomes positifs baignés dans un nuage d'électrons, l'ensemble étant neutre. Ce type de liaison permet d'interpréter les propriétés caractéristiques des métaux et des alliages : propriétés mécaniques, conductivité électrique, conductivité thermique ... Les métaux, et dans une moindre mesure les alliages, sont de bons conducteurs de l'électricité. Une faible différence de potentiel permet de faire circuler facilement les électrons libres, qui n'éprouvent qu'une faible résistance pour leur déplacement. |
|
|
La figure ci-dessous permet de visualiser le phénomène dans le cas d'un réseau cristallin métallique parfait à basse température. 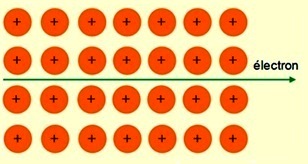 |
Si la température s'élève, les atomes sont soumis à des vibrations de
plus grande amplitude. Les électrons se déplacent alors avec plus de difficulté et de manière chaotique, ce qui diminue la conductivité électrique. 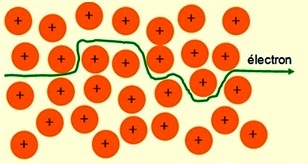 |
Certains métaux possèdent des propriétés très spécifiques :
• les aciers, le titane, ont une excellente résistance mécanique, pas le plomb ni le zinc.
• les aciers au carbone trempés, les aciers au tungstène ont une grande dureté.
• l'or, l'argent, le cuivre, sont des métaux ductiles.
• le plomb est malléable à froid, l'acier est malléable à chaud (laminage).
• l'acier, l'iridium sont très rigides, pas le plomb.
• l'acier pour ressorts est un alliage élastique, le plomb n'est pas élastique.
La liaison métallique étant moins forte que la liaison covalente, les métaux peuvent être déformés sous l'action de forces extérieures et l'on
définit un ensemble de propriétés pour les caractériser.


|
Glissement de couches d'atomes suivant les plans du réseau métallique La liaison métallique étant moins forte que la liaison covalente, les
métaux peuvent être déformés sous l'action de forces extérieures. |
| Pr Robert Valls | robert.valls@univ-amu.fr |
