| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

ÉTUDE DES FAMILLES D'ÉLÉMENTS : le bloc p
Connaissances ... nommer et situer ... la famille de l'oxygène ou colonne 16 ...
La famille de l'oxygène est formée de l'oxygène (O), du soufre (S), du sélénium (Se) qui sont des non métaux, du tellure (Te) qui est un métalloïde ce qui conduira à des propriétés différentes et du polonium (Po) qui est un métal.
Les éléments de la famille de l'oxygène ont une mauvaise conductibilité électrique et thermique, ils possèdent tous six électrons de valence
et ont tendance à donner des ions X2-.
Ils forment donc des liaisons ioniques avec les métaux pour obtenir les deux électrons manquants, ou des liens covalents avec les non-métaux,
afin de partager leurs électrons.
L'ensemble des éléments se lient avec O pour donner des oxydes covalents : SO2, SeO2 (acides forts), TeO2 (acide faible) et PoO2 (amphotère).
L'ensemble de la famille réagit avec H pour donner H2O (liquide), H2S, H2Se, H2Te (gazeux) et H2Po (liquide).
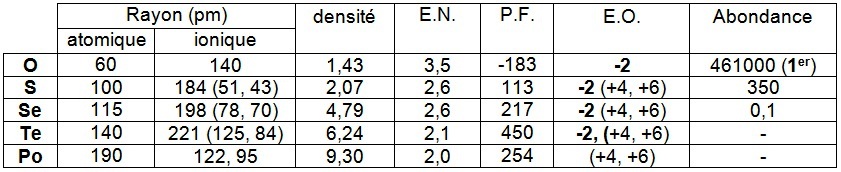
L’oxygène est l’élément le plus abondant de la croûte terrestre, il est présent sous forme d’oxydes que l’on étudiera en détail.
|
oxyde |
SiO2 |
Al2O3 |
CaO |
MgO |
Na2O |
FeO |
K2O |
Fe2O3 |
H2O |
TiO2 |
P2O5 |
|
% masse |
59,7 |
15,4 |
4,9 |
4,4 |
3,6 |
3,5 |
2,8 |
2,6 |
1,5 |
0,6 |
0,2 |
La famille de l'oxygène a autant de points communs que de différences puisque l'on a des non métaux et des métalloïdes.
Ils sont de la même famille puisqu’ils possèdent 6 électrons de valence sur leur dernier niveau et donnent donc deux liaisons.
Ils donnent des liens ioniques avec les autres familles de la région des métaux, aussi bien que des liens covalents entre eux.
| Pr Robert Valls | robert.valls@univ-amu.fr |