| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

ÉTUDE DES FAMILLES D'ÉLÉMENTS : le bloc s
Connaissances ... décrire ... les propriétés chimiques des éléments du bloc s ...
Les éléments du bloc s (hors H et He expliqué par la suite) sont tous des métaux très réactifs, les deux premier éléments (Li et Na) n’ont pas d’orbitale d contrairement aux suivants qui pourront les faire intervenir.
Les ions du bloc s sont trop gros pour former des complexes simples stables mais ils peuvent donner des complexes particuliers appelés chélates avec les molécules dites chélatantes dont on va décrire deux exemples.
Il est nécessaire de comprendre qu'un complexe est un édifice polyatomique constitué d'un (ou de plusieurs) cation(s) entouré(s) de plusieurs ligands, ions ou des molécules qui délocalisent une partie de leur densité électronique sur ce cation, formant ainsi des liaisons avec lui.
Le nombre de liaisons métal-ligand qui se forment définissent des ligands dits monodentates (une liaison), bidentates (deux liaisons), ... polydentates (au delà de deux liaisons) :
- dans le cas des complexes simples, l’atome central est lié à des ligands monodendates,
- dans le cas des chélates (du grec khêlê = "pince"), l’atome central est lié à des ligands polydendate (au moins bidendate).
Le chélate se distingue donc du simple complexe par le fait que le cation métallique est fixé au chélateur par au moins deux liaisons de
coordination et de plus, qu'un (ou des)
cycle(s) à 5 ou 6 chaînons se crée(nt), le chélateur agit alors comme une pince, d'où son nom.
• L’acétylacétone
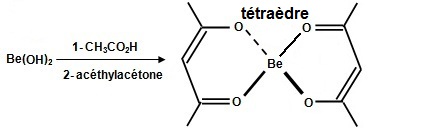
Deux molécules d'acétylacétone (CH3-CO-CH2-CO-CH3) réagissent avec hydroxyde de Béryllium, Be(OH)2 pour donner un chélate stable dont l'atome central présente la géométrie d'un tétraèdre (voir sur "iutenligne la ressource Atomistique et liaison chimique).
|
Le métal (Be) est entouré de 8 électrons (quatre liaisons) aussi, il est sous forme M2+ car deux électrons sont apportés par
chacune des deux cétones (doublets non liants pour une liaison de coordinance) et deux électrons sont apportés par chacun des deux
énolates
R-O-. L’hybridation tétraédrique nécessite l'apport de 8 électrons. On visualise le cycle à six chaînons formés et la pince du chélateur. |
|
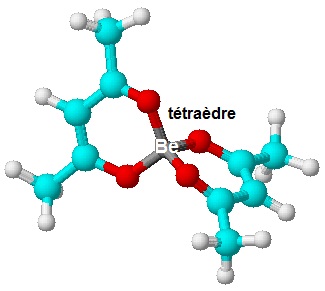
Une représentation en trois dimensions permet de visualiser le tétraèdre que
D'autre types de géométries pourrons se former avec les élément des niveaux L'exemple suivant avec le salicylaldéhyde peut conduire à une géométrie : - similaire avec deux molécules et - plus complexe de bipyramide à base carré, avec trois molécules. |
|
• Le salicylaldéhyde
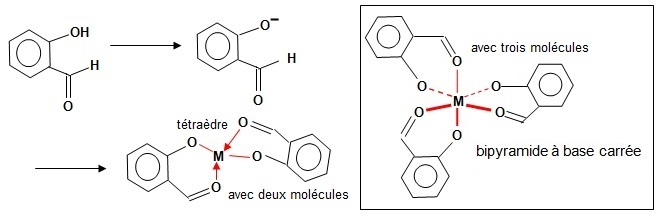
|
Le métal (M) est entouré de 8 ou 12 électrons (quatre ou six liaisons) aussi, il est sous forme M2+ et les électrons sont apportés soit par le carbonyle C=O (doublets non liants pour une liaison de coordinance) soit par phénolate R-O-. L’hybridation tétraédrique nécessite l'apport de 8 électrons et l’hybridation bipyramidale, l'apport de 12 électrons. |
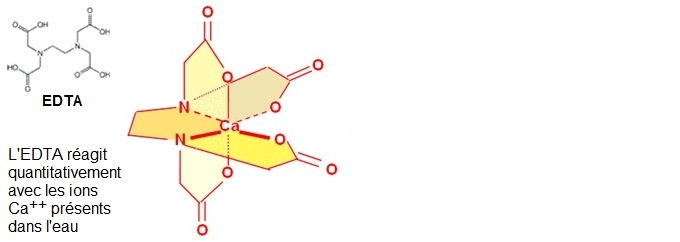
• L’EDTA ou acide Ethylène Diamine TétrAcétique
La stabilité du chélate est due à la formation de cycles à 5 chainons qui donnent une grande stabilité au complexe ce qui permet des dosages quantitatifs des ions calcium et Magnésium.
|
Le complexe est représenté sous une forme simplifiée pour visualiser le positionnement de l'EDTA "autour" de l'ion calcium puis on ne conserve que les liaisons de la molécule chélatante pour visualiser les 5 cycles, numérotés de 1 à 5, qui "enveloppent" l’ion calcium avec enfin ses cinq pinces (numérotées de 1 à 5). |
Les chélates interviennent dans les médicaments pour les carences en métal (apporté sous forme de chélate faciles à assimiler) ou inversement en cas d’intoxication car les chélates sont solubles et peuvent être éliminés par les reins. Ils interviennent dans les engrais, et bien des applications. La nature utilise cette propriété avec le magnésium (dans la chlorophylle), mais plus largement avec le cobalt (dans la vitamine B12), le fer (dans l’hémoglobine), le cuivre (dans l’hémocyanine), …
• Les organométalliques
La chimie du magnésium est surtout connue à travers les organomagnésiens (RMgX) qui présentent un autre type de réactivité que celui des chélates mais avec des points communs.
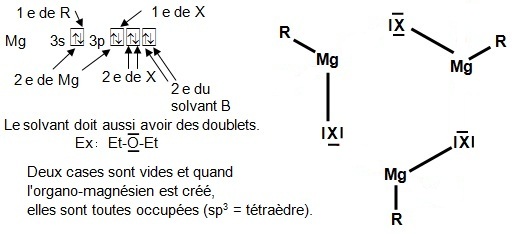
|
La stabilité du complexe s’explique à la fois : par la saturation d’un niveau électronique et
par la formation d’un cycle à six atomes de carbone Mg atome possède 2 électrons qui donnent |
Il existe donc pour ce bloc des organomagnésiens (RMgX) et des organolithiens (RLi) (plus rares, les organosodiques, organopotassiques et organocalciques) mais il existe aussi des organocuprates, organozinciques, organostanniques, organoboroniques, organosilanes, ... qui ne font pas partie de ce bloc et font également intervenir des liaisons métal-carbone.
| Pr Robert Valls | robert.valls@univ-amu.fr |