| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Chimie
inorganique
descriptive
Je consulte
des ressources
sur iut en ligne

RÉACTIVITE DES FAMILLES D'ÉLÉMENTS
Connaissances ... définir ... la polarisabilité ...
La liaison entre deux atomes différents présente en général une dissymétrie de charge entre les deux noyaux liée à leur différence d'électronégativité et on peut assimiler ces atomes à un dipôle :
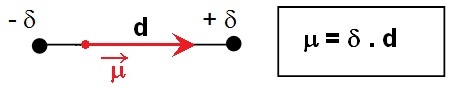 Le vecteur moment dipolaire est orienté de
Le vecteur moment dipolaire est orienté de
la charge - vers la charge +.
La dissymétrie de charge entre les deux noyaux
est due à la différence d’électronégativité entre
les deux atomes.
On considère habituellement que lorsque la différence d'électronégativité entre les deux éléments liés dépasse 0,5 unité dans l'échelle de Pauling, la liaison est polarisée. Il s'agit d'un moment dipolaire permanent, mais il existe des moments dipolaires induits.
Sous l’effet d’un champ électrique (créé par le voisinage d’un ion, d’une molécule, d'un atome …), son nuage électronique peut se déformer temporairement. Il apparaît donc un moment dipolaire temporaire dit induit µi qui dépend du champ électrique E appliqué et de la nature du nuage déformé : µi = α . E µi est en C.m E est en V.m-1 et α est en C.m2.V-1
Le coefficient de proportionnalité α est d’autant plus grand que le nuage est facile à déformer : α est appelé polarisabilité de l’atome, de l’ion ou de la molécule.
Les chimistes ont trouvé l'unité peu pratique et sachant que dans le domaine de l'électrostatique, intervient généralement ε0
(permittivité du vide) sous l'expression (1/4π.ε0) qui est en C-2.J.m et en multipliant la polarisabilité par cette
constante on obtient α'
la polarisabilité volumique en C.m2.V-1 x C-2.J.m = m3
(attention, dans les tables on propose une polarisabilité en cm3 ou en Å3).
|
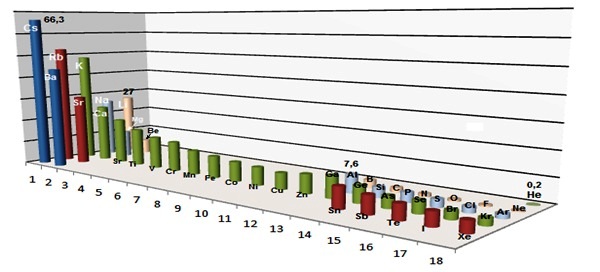
On remarque sur la figure que plus le nuage électronique de l’atome est gros, plus il est polarisable car plus le nuage est gros, plus il est facile de le déformer.
Les ions correspondant à ces atomes vont : - diminuer leur polarisabilité s’ils se chargent positivement car leur taille diminue et l’attraction du noyau sur les derniers électrons est plus forte. |
 |
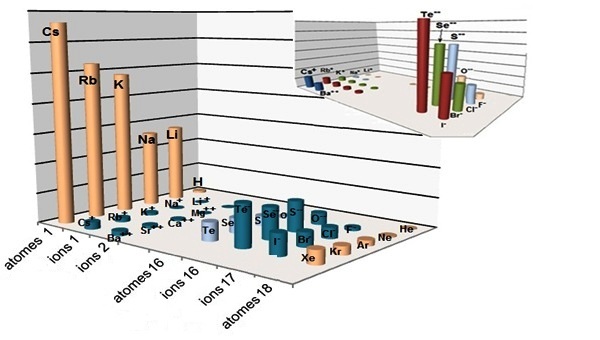 |
Sur la figure de droite on constate que les ions polarisables sont les ions chargés négativement car ils sont gros. Par contre, l’électronégativité des ions s’ils Sur la figure de gauche on observe :
- la chute de la polarisabilité, par exemple
- l’augmentation de la polarisabilité du Te |
L'atome de lithium par exemple, qui est parmi les plus polarisable, mais lorsqu'il s'ionise, devient petit et sa polarisabilité est pratiquement
nulle, mieux encore, il devient polarisant.
Le fluorure de lithium, LiF, que l'on pourrait considérer comme très fortement ionique au vu de la différence d'électronégativité entre les deux
éléments, est en réalité partiellement covalent à cause du pouvoir polarisant très élevé de l'ion lithium.
Ce phénomène s'accentue, par exemple, avec le chlorure de béryllium ou l'oxyde d'aluminium.
|
|
Conseil : les exercices sont proposés dans
les "Compétences",
mais il est préférable de bien apprendre cette partie du cours qui est riche en savoirs et de garder les compétences pour réviser. |
Par soucis d'homogénéité, la plupart des valeurs numériques sont extraites d'un seul ouvrage dont je peux
vous envoyer les références par courriel.
| Pr Robert Valls | robert.valls@univ-amu.fr |