| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Chimie
inorganique
descriptive
Je consulte
des ressources
sur iut en ligne

RÉACTIVITE DES FAMILLES D'ÉLÉMENTS
Connaissances ... définir ... l'affinité électronique ...
L'affinité électronique (AE) d'un atome est l'énergie qui est libérée quand un élément capte un électron.
Définie ainsi, elle est généralement négative : A(g) + 1 e- → A-(g) AE < 0
Quand l'élément capte l'électron et produit un dégagement d'énergie, la réaction est exothermique et ΔH est affecté d'un signe négatif.
Par convention, les valeurs de l'affinité électroniques sont données en valeurs absolues et plus la valeur de l'affinité électronique est grande,
plus l'élément est un bon capteur d'électrons.
|
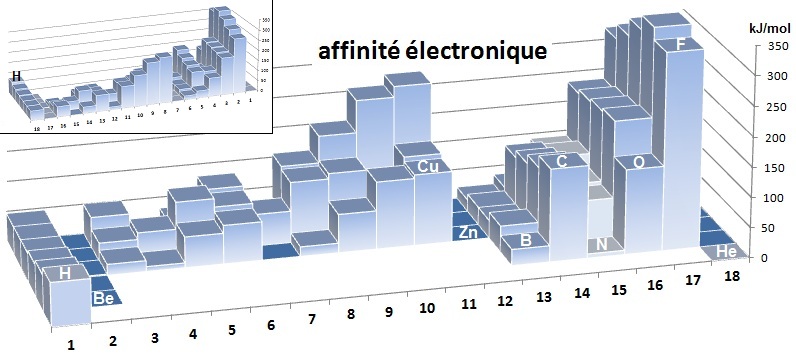
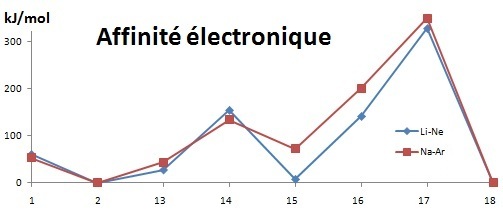
L'affinité électronique augmente globalement en traversant une période de gauche à droite mais varie très peu en descendant une famille (écart entre les deux courbes). Les alcalino-terreux n'ont pas d'affinité électronique ni les gaz rares car on ne connaît pas par exemple Mg-ou Ar-. C'est une donnée expérimentale qui fournit des renseignements beaucoup moins précis que l'énergie de première ionisation mais qui permet de visualiser l'effet stabilisant des sous couche remplies (2 et 18) ou semi remplies (15). |
 |
Cette vue présente la classification dans un sens inhabituel, l'hydrogène est à droite et en bas, puisqu'on l'a inversée pour mieux visualiser les différentes caractéristiques de celle-ci (au dessus, on présente la classification dans le sens habituel).
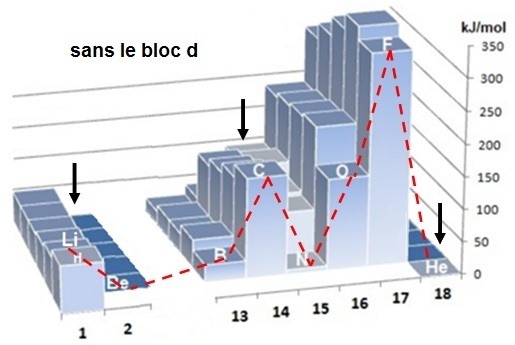
Globalement l’affinité électronique augmente de la gauche vers la droite mais on note trois familles (celle du béryllium et celle de l’azote et celle de l’hélium respectivement colonnes 2, 15 et 18) pour lesquelles il y a des anomalies liées respectivement à la couche s complète (Be), p demi complète (N) et p complète (He) pour qui il n'y a pas d'affinités électroniques.
On visualise également la colonne 12 pour laquelle la sous couche d est complète et qui aura une affinité électronique nulle.
Les halogènes (colonne 17)
ont la plus grande affinité électronique puisqu'il obtiennent la configuration du gaz rare par
addition d'un électron.
De même, la colonne 11 qui complète
la sous couche d par addition d'un électron présente une
affinité électronique importante.
|
|
Conseil : les exercices sont proposés dans les "Compétences
", mais il est préférable de bien apprendre cette partie du cours qui est riche en savoirs et de garder les compétences pour réviser. |
Par soucis d'homogénéité, la plupart des valeurs numériques sont extraites d'un seul ouvrage dont je peux
vous envoyer les références par courriel.
| Pr Robert Valls | robert.valls@univ-amu.fr |