| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

RÉACTIVITE DES FAMILLES D'ÉLÉMENTS
Connaissances ... définir ... le potentiel d'ionisation ...
Le potentiel d'ionisation (PI ou In) est l'énergie qu'il convient de fournir à un atome gazeux pour lui arracher un ou plusieurs électrons.
I1 correspond au potentiel de première ionisation : A(g) → A+(g) + 1 e-
On utilise aussi le potentiel de deuxième ionisation I2 (si l’on extrait un second électron), I3 …
I1 augmente en traversant une période (de gauche à droite) et diminue en descendant une famille (de haut en bas).
Plus l'atome est gros plus l'électron périphérique est éloigné du noyau et moins il est attiré. Aussi, il sera coûteux en énergie, d'ioniser les atomes des éléments chimiques de la colonne des halogènes ou, a plus forte raison, de celle des gaz rares.
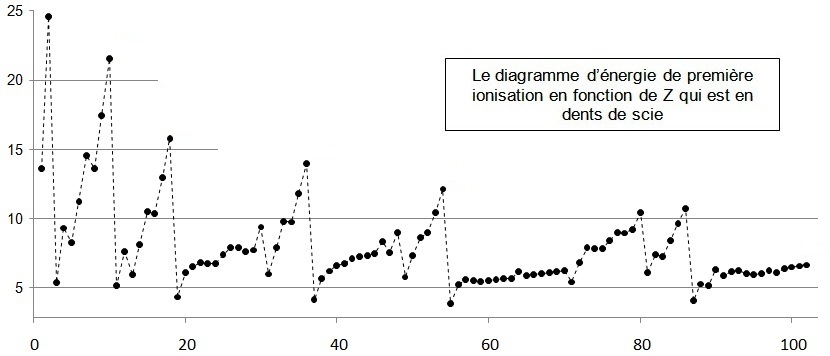
cliquer sur la figure pour retrouver l'état initial
Les
flèches signalent une diminution du potentiel d’ionisation qui montre la stabilité plus grandes des orbitales complètes
(He = 2s2 complète) ou demi complète (P = 3p3 demi complète). On peut noter que le potentiel d’ionisation avec l'affinité électronique,
seront les seules grandeurs qui montrent cette stabilité.
On note également que l'on retrouve ce type de courbe pour l’ensemble des périodes mais que le phénomène s’amortit.
Une autre représentation basée sur la classification est à mémoriser, on y retrouve les mêmes valeurs mais positionnées selon la classification. On remarque l'analogie avec la variation de l'électronégativité quant à l'allure générale de la représentation.
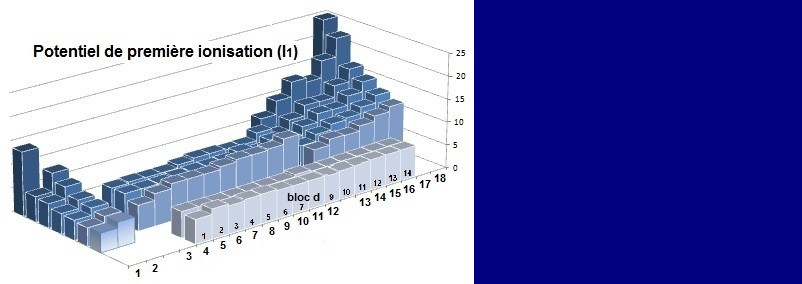
cliquer sur la figure pour retrouver l'état initial
Cette vue montre que globalement les potentiels d’ionisation augmentent de la gauche vers la droite (H est particulier) et on note deux familles (celle du bore et celle de l’oxygène) pour lesquelles il y a une anomalie liée à la couche s complète ou p semi complète.
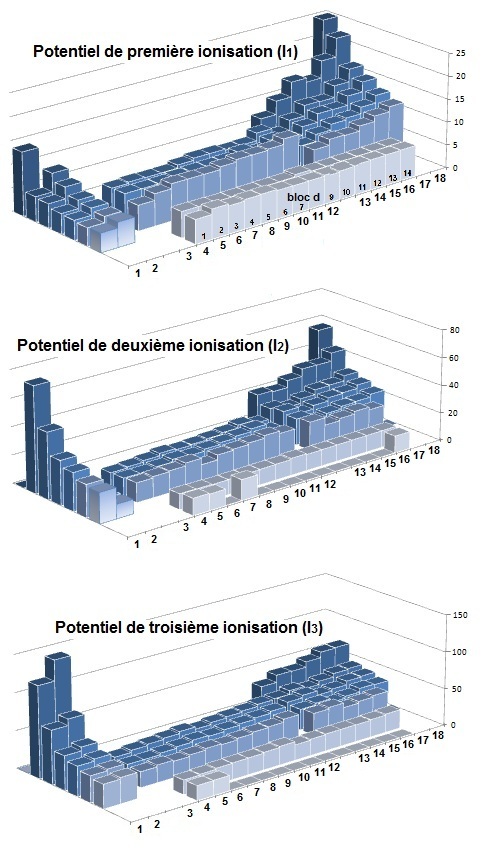 cliquer sur la figure pour retrouver l'état initial |
L’énergie de première ionisation I1 est la plus grande pour les gaz rares puisqu’ils ont une couche de valence saturée et diminue jusqu’aux alcalins. On observe des anomalies : • pour H (et par relation diagonale avec Mg) Toutes les valeurs des PI ne sont pas disponibles aussi, certains éléments sont à zéro.
L’énergie de de deuxième ionisation I2 est la plus grande pour les alcalins car si la perte du premier électron est facile (elle aboutit à la configuration électronique de l’Hélium), arracher le deuxième électron est plus difficile car il impose la perte de la configuration d'un gaz rare.
L'énergie nécessaire pour arracher ce deuxième électron sera plus grande que celle nécessaire pour arracher le premier du gaz rare puisque le noyau est plus chargé. L'hydrogène a disparu car on ne peut lui arracher que le seul électron qu'il possède et il n'y a pas de I2.
L’énergie de de troisième ionisation I3 est donc la
plus grande pour les
alcalino-terreux puisque leur arracher deux électrons les conduit à la configuration du gaz rare le plus proche. Les valeurs moyennes des I3 sont environ du triple des I1. |
Par soucis d'homogénéité, la plupart des valeurs numériques sont extraites d'un seul ouvrage dont je peux
vous envoyer les références par courriel.
| Pr Robert Valls | robert.valls@univ-amu.fr |