| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Chimie
inorganique
descriptive
Je consulte
des ressources
sur iut en ligne

RÉACTIVITE DES FAMILLES D'ÉLÉMENTS
Connaissances ... définir ... les rayons ioniques ...
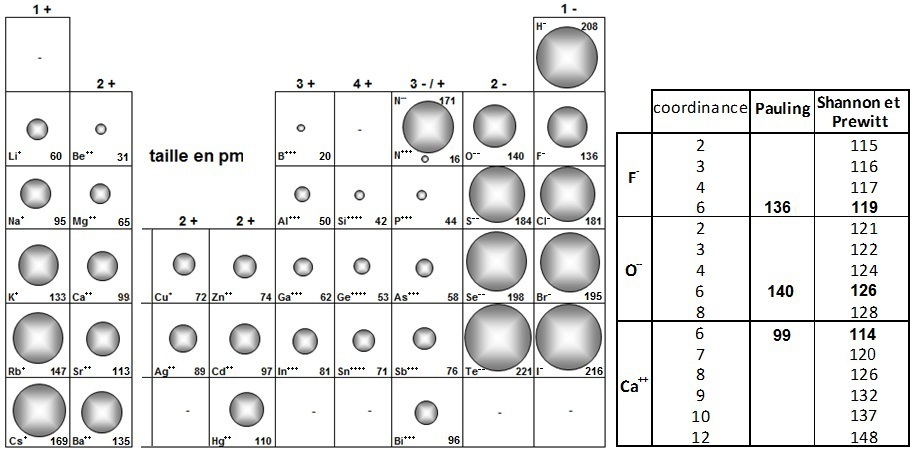
Le rayon ionique (Rion) d'un élément dépend de sa charge car pour un élément donné, plus la charge est grande, plus le rayon diminue et RFe2+ > RFe3+, RCu+ > RCu2+, ... et si l’on considère les ions les plus courants, on constate que, globalement :
• les ions négatifs sont plus grands que les ions positifs
• pour une famille donnée (alcalins = colonne 1) du Li+ au Cs+ ou (halogènes = colonne 17) du F- au I-
les rayons augmentent
• pour une période donnée du Na+ au Si4+, la taille des ions isoélectroniques diminue en même temps que la charge augmente
Plusieurs types de rayons ioniques, selon :
♦ Pauling qui prend comme référence O2- = 140 pm et F- = 136 pm
♦ Shannon et Prewitt qui proposent des valeurs qui semblent le mieux correspondre à la taille réelle des ions dans les cristaux
(référence F- = 119 pm pour une coordinance de 6) et qui prennent en compte la coordinance des ions.
Il en résulte, une taille d'environ 14 pm plus petite pour les ions négatifs et de 14 pm plus grande pour les ions positifs, mais l'apport
important a été de proposer des rayons en fonction de la coordinance (par exemple, pour l'ion Ag+ on observe un rayon de 67 pm en
coordinance 2 et de 115 pm en coordinance 6).
Les plus utilisés en chimie sont ceux de Pauling mais ceux de Shannon et Prewitt seront utilisés en cristallographie (voir sur "iutenligne" la ressource "Chimie du solide et matériaux").
Quelques valeurs des rayons ioniques selon Pauling sont proposées dans le tableau ci-dessous.
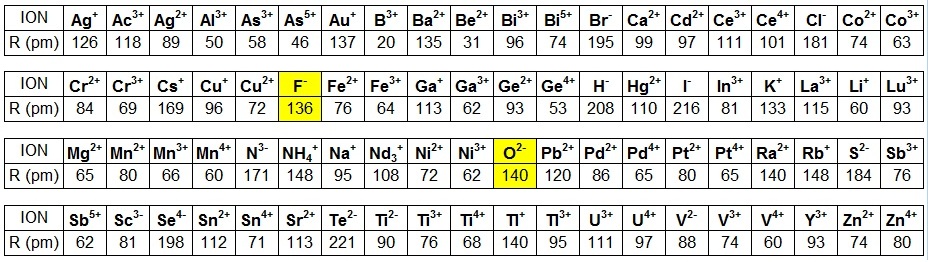
On peut considérer que les ions existent dans les cristaux (bien que dans LiI, il y ait 50% de caractère covalent et que l’on décrive les
ions Li+ et I-) et en solution hydratés (H3O+) ou fortement oxygénés (MnO4-) qui correspondent à des états d'oxydation élevés.
Leur nombre est très important aussi dans ce tableau on ne propose que les ions monoatomiques (à l'exception de NH4+).
• l’ion le plus petit sera le plus à gauche et le plus haut possible dans la classification, on obtient Li+ ... mais attention, Be2+, B3+seront plus petit car plus chargés ...
• l’ion le plus gros sera le plus à droite et le plus bas possible dans la classification, on obtient I- ... mais attention, comme son voisin Te2- a deux charges négatives, il sera plus gros (il faut penser aussi ... aux ions positifs en bas à gauche de la classification qui ont un rayon important).
Par soucis d'homogénéité, la plupart des valeurs numériques sont extraites d'un seul ouvrage dont je peux
vous envoyer les références par courriel.
| Pr Robert Valls | robert.valls@univ-amu.fr |