| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Chimie
inorganique
descriptive
Je consulte
des ressources
sur iut en ligne

ÉTUDE DES GRANDES FAMILLES DE COMPOSÉS INORGANIQUES
Compétences ... utiliser ... la classification pour retrouver des caractéristiques des éléments ... pour proposer des ions ...
En vous appuyant sur la classification retrouver les caractéristiques chimiques des éléments et proposer des ions pour les éléments.
Conseil : Lire attentivement le cours avant de commencer.
On a vu le positionnement des métaux (qui donnent des composés métalliques et ioniques), des non métaux (qui donnent des molécules), des métalloïdes (qui ont au moins une propriété des métaux et une des non métaux), des éléments radioactifs, des gaz rares, des halogènes, des chalcogènes, des lanthanides et des actinides.
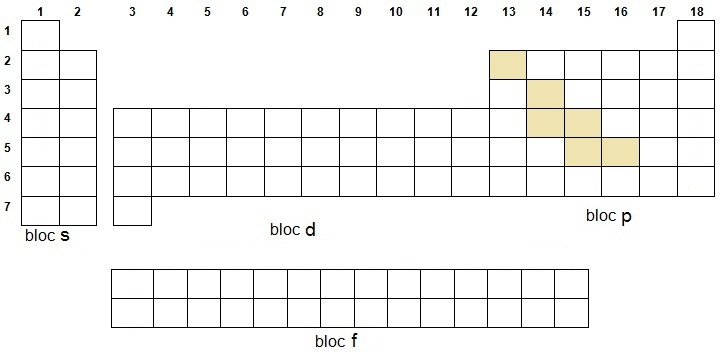 |
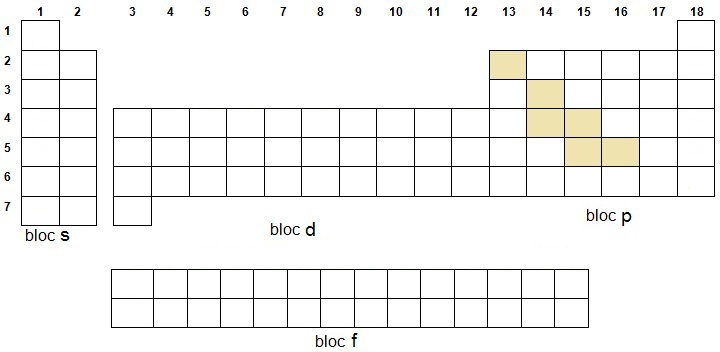
La position des métaux
et non métaux découle de celle des métalloïdes
puisqu'ils forment une diagonale qui les sépare et traverse le bloc p
de gauche à droite et de haut en bas. Pensez à l'Hydrogène et à l'Hélium car ils sont particuliers car s'ils appartiennent à l'orbitale s, n'en ont pas les propriétés. Pour les éléments radioactifs, il suffit de retenir le chiffre 83 (Bismuth) et de ne pas oublier Tc et Pm (on peut insérer le bloc d). On peut ajouter les ferromagnétiques, les terres rares et le groupe du platine. |
Pour les ions, c'est moins simple car les éléments donnent des ions allant de -3 à +8 aussi, sur la figure ci-dessous, on a indiqué en bleu foncé les ions principaux et en bleu clair un ion secondaire, sachant que d'autre états d'oxydation sont possibles et que certains éléments ne donnent généralement pas d'ion :
| ●
+1 = colonne 1 et Tl colonne 13 (doublet inerte) ● +2 = colonne 2, 10, 12 et la première ligne du bloc d (sauf les trois premiers qui donnent respectivement +3, +4 et +5), Sn et Pb colonne 14 (doublet inerte) ● +3 = colonne 3, 13 (sauf le B), 15 (doublet inerte sauf N, P et As) la première ligne du bloc d (sauf Mn, Cu et Zn) et le bloc f (sauf actinides Th à Pu). Les degrés d'oxydation ±1, ±2 et ±3 concernent quasiment tous les éléments. ● +4 = colonne 4, cinq éléments du bloc d et cinq actinides du bloc f, mais c'est la colonne 4 qui est à retenir en priorité. |
 |
|
● +5 = colonne 5 et deux actinides (Pa et Np), il s'agit d'états d'oxydation car les ions possédant autant de charges ne sont pas stables sauf sous forme d'oxyde (V2O5) et l'ion se trouve dans la cristal avec une part de covalence.
●
+6 = colonne 6 et comme précédemment, ces ions correspondent à ● +7 = colonne 7, on atteint les états d'oxydation les plus élevés.
●
+8 = colonne 8, on atteint l'état d'oxydation le plus élevé et seul deux |
On a retenu presque tous les ions courants positifs et pour les négatifs, la liste est beaucoup plus courte car le nombre des non métaux est réduit par rapport aux métaux : ● -1 = colonne 17, ce sont les halogènes. ● -2 = colonne 16, ce sont les chalcogènes.
●
-3 = colonne 15 mais il n'y a que N et P.
Des information complémentaires sont proposées dans le cours. |
Quelques éléments donnent des ions positifs et négatifs, ce sont des métalloïdes mais aussi des non métaux qui par combinaison avec d'autres non métaux plus électronégatifs (voir sur "iutenligne" la ressource Atomistique et liaison chimique) conduiront à des états d'oxydation positifs comme pour Br ou I dans BrF5 ou ICl4.
Il est toujours délicat de décrire des ions car certains ions existent :
Pour chaque élément, selon que l'on s'intéresse à la chimie des solutions, à la
chimie du solide ou autre, les degrés et les états d'oxydation
seront différents. Si l'on fait l'inventaire de tous les ions possibles (quelle que soit leur stabilité), la liste est très grande.
• en solution aqueuse (Na+,
Cl-, ...)
• dans des solides cristallins (Na+,
Cl-, S2-, P3-, N3-, ...)
• dans des ions oxygénés (SO42-, MnO4-, ... on
parle d'état d'oxydation car l'ion n'existe pas)
• dans des complexes (Mg2+ = chlorophylle, Co2+ = vitamine
B 12, ...)
• dans les intermédiaires réactionnels (NO2+,
Br+, ...)
• dans l'espace (CH5+, H3+, ...)
Nous avons mis en avant la chimie des solutions et du solide en précisant l'origine des ions particuliers.
| Pr Robert Valls | robert.valls@univ-amu.fr |