| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Chimie
inorganique
descriptive
Je consulte
des ressources
sur iut en ligne

ÉTUDE DES GRANDES FAMILLES DE COMPOSÉS INORGANIQUES
Connaissances ... définir ... Les blocs ...
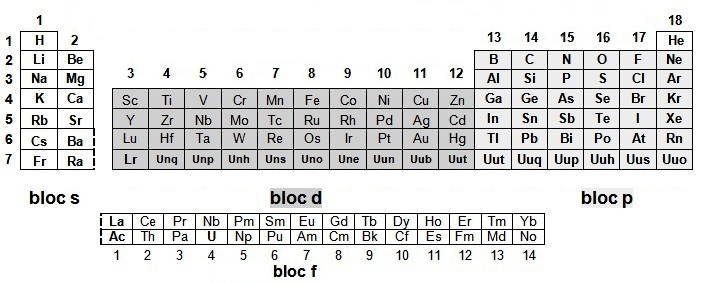
On peut découper le tableau périodique en 4 blocs que l'on désigne par les lettres s (sharp) qui compte deux familles, puis p (principal) qui en compte six, puis d (diffuse) qui en compte 10 (ou huit selon les dénominations choisies) et enfin f (fundamental) :
cliquer sur la figure pour retrouver l'état initial
Le bloc f constitué des lanthanides et les actinides est représenté sous le tableau afin d’en limiter la taille.
Le bloc s est constitué de métaux, il correspond aux colonnes 1 et 2 du tableau périodique, respectivement celles des alcalins
(cation de type M+) et des alcalino-terreux (cation de type M2+).
L'Hydrogène et l'Hélium font partie du bloc s mais sont particuliers (ils seront étudiés par la suite),
il suffit de retenir que l'on place
l'Hélium au dessus du Néon.
Le bloc p est constitué de métaux, de non métaux et de métalloïdes (colonnes 13 à 18) :
| ● colonne 13 = la famille du Bore | ● colonne 14 = les cristallogènes |
| ● colonne 15 = les pnictogènes, anions trivalents X3- | ● colonne 16 = les chalcogènes, anions divalents X2- |
| ● colonne 17 = les halogènes anions monovalents X- | ● colonne 18 = les gaz rares très stables chimiquement |
Le bloc d est le bloc le plus complexe
(et sera détaillé ultérieurement)
mais n'est constitué que de métaux.
La première ligne de ce bloc, contient les deux premières exceptions
à la règle de Klechkowski (le Chrome et le Cuivre).
Le bloc f est placé sous la classification pour la rendre plus compacte et on le qualifie parfois de "bloc des métaux de transition interne".
Si l'on
insère le bloc f à sa place, on obtient une classification à 32 colonnes, on peut alors lire
du premier élément (1 ou H) en haut à gauche au dernier (118 ou Uuo) en bas à droite par Z croissant
et dans l’ordre de remplissage.
cliquer sur la figure pour retrouver l'état initial
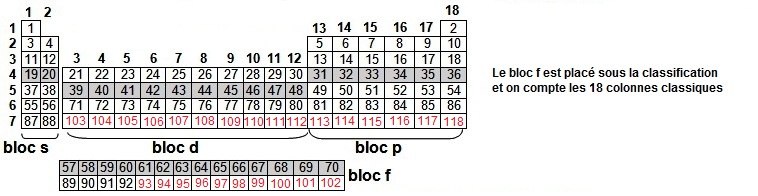
Les
quatorze
éléments (58 à 71 inclus) qui suivent le lanthane (57) sont appelés lanthanide ou
terres rares si l'on
associe la colonne 3.
Sous les lanthanides il y a la
famille
des actinides (89 à 103 inclus) donc le chef de file est l'Actinium (89).
Au-delà de l'uranium (92), dernier élément naturel, on aborde les transuraniens, c'est à dire des
éléments
artificiels (élaborés à partir de 1945 et indiqués en rouge).
Remarque : Le Lanthane devrait s’écrire [Xe] 4f15d06s2 mais c’est une exception à la règle de Klechkowski
et sa structure est [Xe] 4f05d16s2 et le
dernier électron se positionne sur l'orbitale d et non sur l'orbitale f.
A ce titre, il a été le premier élément du bloc 5d mais
comme il est l’élément 57 on peut aussi le considérer comme le premier
élément du bloc f (on observe les deux possibilités selon les classifications)
et dans ce cours, il sera placé comme 57ème élément.
| Pr Robert Valls | robert.valls@univ-amu.fr |