| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Chimie
inorganique
descriptive
Je consulte
des ressources
sur iut en ligne

STRUCTURE ÉLECTRONIQUE DES ATOMES
Connaissances ... définir ... Les différents nombres quantiques ...
Les électrons se répartissent selon des règles bien définies et chaque électron peut être identifié de façon unique par
quatre
nombres
quantiques que l'on désigne par les lettres n, l, m et s :
Le nombre quantique principal, désigné par la lettre n est un entier positif :
• il définit le niveau d'une couche électronique
(niveaux 1 à 7 de l'hydrogène au 118ème élément mais 103 présentés dans la
classification)
• il est associé aux périodes de la classification (pour
le bloc s) : période 1 ou K ; période 2 ou L ; période 3 ou M ... 4 ou N ... 5 ou O …
• il permet de calculer le nombre maximum d’électrons contenus dans la couche n par le calcul de l'expression 2n2
Le nombre quantique azimutal, désigné par
la lettre l est un entier positif :
• il définit la nature des orbitales, pour le niveau n, il prend
(en théorie) les valeurs entières comprises entre 0 et n – 1
• on associe le chiffre : l = 0 à l’orbitale
s l = 1 à l’orbitale
p l = 2
à l’orbitale d
l = 3 à l’orbitale f
Le nombre quantique magnétique, désigné
par la lettre m est un entier positif ou négatif
compris entre - l et
+ l.
Il correspond à des orbitales de même type (s, p, d ou f) mais localisées différemment dans l’espace.
Par exemple, il y a trois orbitales p : px, py et pz donc l = 1 et m est compris entre ±1 soit m = -1, 0 et +1
Les nombres quantiques n, l et m définissent une orbitale donnée, elle ne peut contenir que 2 électrons au maximum.
Le nombre quantique de spin, s est un moment angulaire et prend les valeurs + ½ et - ½.
Deux électrons d’une orbitale diffèrent uniquement par ce nombre quantique (Pauli).
La structure électronique des atomes est symbolisée par l’énumération des sous couches électroniques (s, p, d et f) par n croissant, précédées de leur niveau (n) et suivies du nombre d’électrons présents indiqués en exposant (voir "iutenligne" puis "Atomistique et liaison chimique).
Par exemple, la structure électronique du sodium s'écrit :
Na 1s22s22p63s1
il s'agit du 11ème élément, il possède 11 électrons = somme des exposants = 2 + 2 + 6 + 1 = 11
Il faut retenir que : le niveau 1 en compte 1 = la sous couche s unique qui est donc aussi la couche de valence
le niveau 2 en compte 2 = s et p
le niveau 3 en compte 3 = s, p et d
le niveau 4 en compte 4 = s, p, d et f
le niveau
5
en compte 5 = s, p, d, f et
(g) mais la cinquième et au delà n'existe pas dans les éléments naturels
le niveau 6 en compte 6 (théoriquement) = s, p, d
(f, g et h) sachant que la 6d ne contient que des éléments artificiels
le niveau 7 en compte 7 (théoriquement) = s, p (d, f,
g, h et i) sachant que la 7p ne contient que des éléments artificiels
On peut retenir que la somme n + l est au maximum de 8 soit 5f (5+3), 6d (6+2) et 7p (7+1).
Pour plus de rapidité dans l’écriture de la structure électronique , on utilise la structure du gaz rare qui précède l’élément selon :
11Na : 1s22s22p63s1 = 11Na : (Ne) 3s1
56Ba : 1s22s22p63s23p63d104s24p64d10(4f0)5s25p66s2 = 56Ba : (Xe) 6s2
Bien différencier une structure électronique (par n croissant) de l'ordre
de remplissage (par énergie croissante = somme n + l croissante).
Rappel de la règle de Hund
Les électrons occupent un maximum d'orbitales de même énergie définies par le nombre quantique azimutal
l avant de les compléter par
un deuxième électron de spin opposé.
Par exemple, les orbitales p, se remplissent
de l'électron 1 à l'électron 6 selon l'animation proposée sur les
orbitales p ci-dessous.
Les différentes valeurs du nombre quantique m peuvent être retrouvées à l’aide des cases quantiques et l'on obtient également
le nombre maximum d’électron par sous couche et donc par niveau :
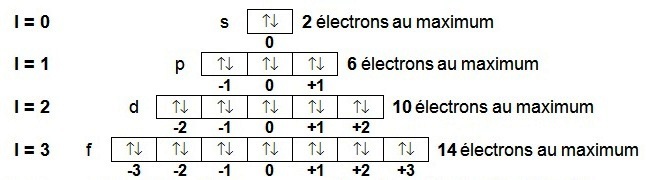
On peut obtenir le nombre d'électrons par niveau :
| niveau 1 = 1s = 2 e ou 2n2 = 2 x 12 = 2 e | niveau 2 = 2s et 2p = 2 + 6 = 8 e ou 2 x 22 = 8 e |
| niveau 3 = 3s, 3p et 3d = 2 + 6 + 10 = 18 e ou 2 x 32 = 18 e | niveau 4 = 4s, 4p, 4d et 4f = 2 + 6 + 10 + 14 = 32 e ou 2 x 42 = 32 e |
Attention, le croisement des niveaux devra être pris en compte pour totaliser les électrons d'une période qui est différent du nombre d'électrons par niveau.
| Pr Robert Valls | robert.valls@univ-amu.fr |