| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne
STRUCTURE ÉLECTRONIQUE DES ATOMES
Correction de l'exercice : Les différents principes de répartition des électrons ...
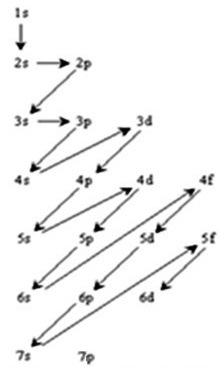
a- Utiliser la règle de Klechkowski pour classer les sous couches.
On dessine la table de Klechkowski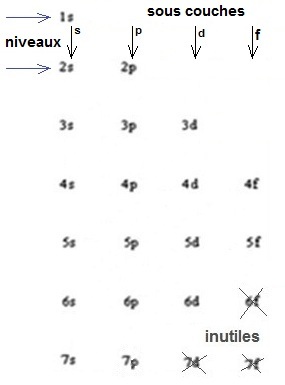 |
On complète par les valeurs de n+l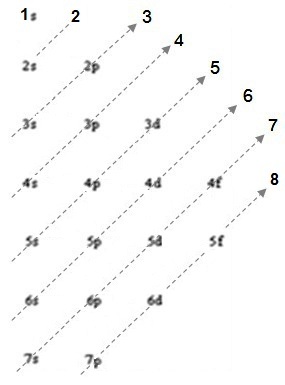 |
On indique les flèches par n+l croissant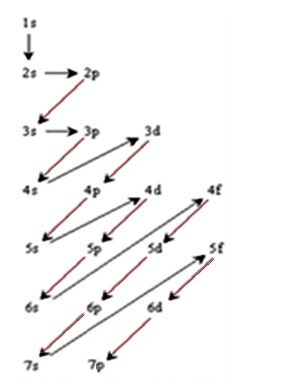 |
Pour bien comprendre le fonctionnement de cette table, je vous propose de calculer la somme des n+l :
| pour 1s | n+l = 1 + 0 = 1 | |||||||||
| pour 2s | n+l = 2 + 0 = 2 | |||||||||
| pour 2p | n+l = 2 + 1 = 3 | et | 3s | n+l = 3 + 0 = 3 | ||||||
| pour 3p | n+l = 3 + 1 = 4 | et | 4s | n+l = 4 + 0 = 4 | ||||||
| pour 3d | n+l = 3 + 2 = 5 | et | 4p | n+l = 4 + 2 = 5 | et | 5s | n+l = 5 + 0 = 5 | |||
| pour 4d | n+l = 4 + 2 = 6 | et | 5p | n+l = 5 + 1 = 6 | et | 6s | n+l = 6 + 0 = 6 | |||
| pour 4f | n+l = 4 + 3 = 7 | et | 5d | n+l = 5 + 2 = 7 | et | 6p | n+l = 6 + 1 = 7 | et | 7s | n+l = 7 + 0 = 7 |
| pour 5f | n+l = 5 + 3 = 8 | et | 6d | n+l = 6 + 2 = 8 | ||||||
|
Lorsque la somme est identique c'est l'orbitale atomique possédant la plus petite valeur de n qui se rempli d'abord. Si l'on détaille pour l'avant dernière
ligne orbitale f, n = 4 donc, d'après Klechkowski :
l'orbitale
4f se remplie d'abord (n le plus petit) |
 |
Pour visualiser en dynamique :
|
Pensez à revenir à la page "
Connaissances et compétences" pour vérifier vos acquisitions.
| Pr Robert Valls | robert.valls@univ-amu.fr |