Le mécanisme est alors le suivant :
première étape = R-X donne un intermédiaire réactionnel entre R-X et HO-.
deuxième étape = X- se détache de l'intermédiaire réactionnel pour donner l'alcool et KX.
Le mécanisme proposé à donc une première étape "lente" qui impose la cinétique, la formation de
l'alcool sera
instantanée
("rapide") et ne sera pas considérée dans l'étude cinétique.
Donc, les 2 réactifs sont indispensables pour former l'intermédiaire réactionnel et seront
considérés du point de vue
cinétique.
Une explication plus moléculaire s'impose :
Cliquer sur la figure pour obtenir le schéma initial
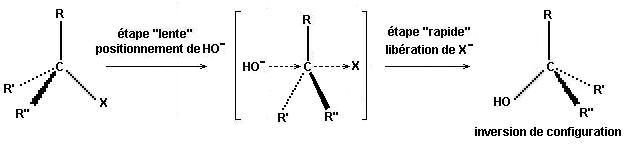
L'étape "lente" est le
positionnement de HO- qui conduit à l'intermédiaire réactionnel qui fait
intervenir R-X et HO- ce qui
amène à considérer un ordre 2. Le
départ de X- est instantané
et donne l'alcool.
Si le dérivé halogéné possède un carbone asymétrique (qui porte l'halogène), le passage
par cet intermédiaire
réactionnel conduit à une
inversion du carbone asymétrique.
Les SN2 conduisent à une inversion de configuration des carbones concernés s'ils sont asymétriques.
Remarque : ce mécanisme est favorisé lorsque R, R' et R" n'ont pas ou peu d'effets inductifs
donneurs, alors le
carbocation
ne peut se former et la seule possibilité est la formation d'un
intermédiaire réactionnel qui fait intervenir R-X
et HO-.
L'encombrement stérique peut intervenir mais sera vu en chimie organique.
Cette partie de cours est principalement constitué de connaissances aussi vous devez la lire attentivement et la retenir.
Thermodynamique et cinétique Mécanismes
Pr Robert Valls & Dr Richard Frèze robert.valls@univ-amu.fr