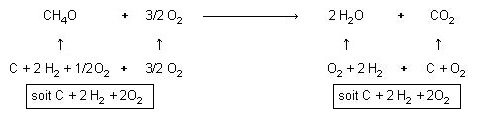
Il faut noter que les réactions chimiques ne sont que des recombinaisons d'atomes.
Par exemple : CH4O + 3/2 O2 → 2 H2O + CO2
Ces molécules dérivent toutes des corps simples C, H2 et O2.
Partant des corps simples, on peut obtenir toutes les combinaisons existantes :
C + 2 H2 + 1/2 O2 → CH4O
............
(correspond à l'enthalpie de formation de CH4O)
H2 + 1/2 O2 → H2O
..........................
(correspond à l'enthalpie de formation de H2O)
C + O2 → CO2
..................................
(correspond à l'enthalpie de formation de CO2)

Dans les deux cas on obtient le même résultat (C + 2 H2 + 2 O2)
ce qui n’est pas surprenant car la
nature et le nombre
des atomes ne change pas lors d’une réaction chimique.
Il n’intervient que des enthalpies de formation.
Conclusion : on peut obtenir l’enthalpie d’une réaction connaissant les
enthalpies de formation de
tous les réactifs et
de
tous les produits par la construction d'un
cycle à 3 étapes.
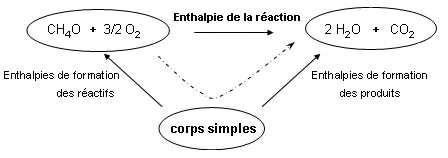
L'enthalpie d'une réaction est donc égale à la somme des enthalpies de formation
des produits
moins la somme des
enthalpies de formation des réactifs.
On peut construire la même démonstration avec les enthalpies de combustion (attention au sens des flèches) et on conclut :
L'enthalpie d'une réaction est donc égale à la somme des enthalpies de
combustion des réactifs
moins la somme des enthalpies de combustion des produits.
Pour les cycle à 4 étapes voir "Energie interne - Enthalpie".
Pour les cycle à plus d'étapes, il faut traiter
au cas pas cas.
A retenir :
La définition d'une enthalpie de formation.
La définition d'une enthalpie de combustion.